- Research Projects
- 細胞膜付近で生成される様々なシグナルがどのように遺伝子情報を制御しているのかを明らかにするためには、シグナルが転写因子群活性を空間時間的にどのように制御するのか、シグナルが転写開始過程や転写伸長過程をどのように制御するのかを明らかにすることが重要であろう。主にSTAT3とERK伝達系を活性化するIL-6/gp130シグナルに加え、TGFbや増殖因子を用いて転写を伴なう細胞応答の仕組みを解析している。研究の進展に伴い、転写因子、キナーゼ、ユビキチンリガーゼ、転写活性化と伸長過程を制御する分子群と登場人物が増えてきている。以下のようなプロジェクトで中嶋の指導のもと研究を進めている。
|
- Project 1
- 細胞を刺激すると速やかに転写レベルで発現が誘導される転写因子群がある。これらには、c-Fos,
JunB, c-Jun, c-Myc などがありこれらの量や活性がその後の応答の行方の決定に関わる。STAT3 自身もSTAT3
により発現が誘導される。このような転写因子群は、リン酸化状態、ユビキチン化、SUMO化他の修飾や他の蛋白との結合などで制御を受けている。シグナルによる転写因子群の制御機序を検討するため、STAT3
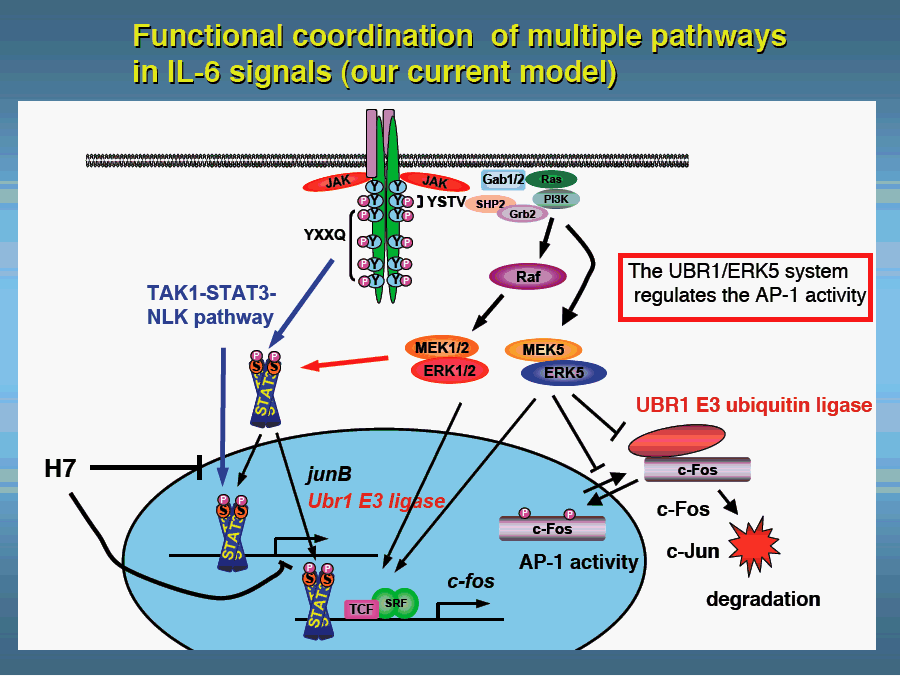
とAP-1 を構成する分子群(c-Fos, c-Junなど)を対象として解析している。すでにSTAT3 Ser727リン酸化をもたらすキナーゼ系TAK1-STAT3-NLK系を見い出し、またERK5
とUBR1によるc-Fos 核局在と安定性制御機序を見い出した。後者の研究からは、c-Fos制御系の全容解明というテーマ、UBR1によるAP-1
構成分子群の制御というテーマが始まっている。(佐々木、岸本、野沢)
|
- Project 2
- 細胞内シグナルは転写因子ばかりでなく転写開始、伸長、RNA processing に関わる様々な核内蛋白群を標的としていると考えられる。これら標的分子を明らかにし、役割を解明することは、シグナルによる遺伝子発現制御の理解が深まるばかりでなく、シグナル制御法獲得のための基礎となろう。最近の研究成果から、我々は、IL-6シグナルによるSTAT3を介した遺伝子発現や血清で刺激されるc-fos遺伝子の発現には、CDK9に加えCDK9とは異なるキナーゼが転写伸長を制御しているとのモデルを提唱している。これらキナーゼの同定が重要課題である。複数のシグナルにより活性化される複数の転写因子は転写開始レベルだけでなく転写伸長レベルでも協調作用をもつとの仮説を提起していきたい。これらを解明することは生命神秘の理解につながることであろう。制御ポイントとして転写伸長速度もあると考えている(國本、福角)
|
- Project 3
- UBR1というE3 ユビキチンりガーゼは、通常はなんらかの仕方で切断された蛋白のN末アミノ酸が酸性であったり疎水性であるものを認識する。しかし、c-Fosの場合には、内部配列を認識することを示した。Johanson-Blizzard
syndoreme(膵臓外分泌不全、知能発育不全、鼻翼形成不全、鎖肛、永久歯欠損など多彩な症状を呈する常染色体劣性遺伝疾患)の原因がUBR1
欠損であると報告され、その疾患発症機序に関わるUBR1基質の同定が重要である。AP-1に加えてUBR1基質同定を行う。(野沢、佐々木)
|
- Project 4
- gp130のYXXQモチーフに由来するTAK1-STAT3-NLK経路の活性化機序、この経路により制御される核内蛋白群の同定などこの経路の全容解明、免疫系における役割解明を目指す。(小島、佐々木)
|
- Project 5
- 新たなヘルパーT 細胞としてIL-17を産生し、炎症細胞を集めるTH17細胞が注目を集めている。この細胞サブセットは、TGFbとIL-6作用のもと分化してくると報告された。TGFbによる制御性T
細胞Tregの分化の条件にIL-6を加えると、Tregの産生が抑制されかわりにTH17 細胞が多く生まれてくる。TGFbとIL-6という二つのサイトカインによる細胞分化の制御、細胞運命の決定機序の解明を目指す。(佐々木、小島、國本、福角、野沢)
|
|
-
IL-6 signals 概要2006版
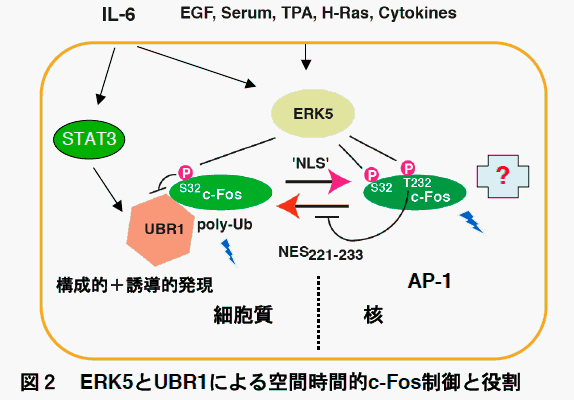
次の図は、Molecular Cell 24, 63-75, 2006に報告したものから、ERK1,
UBR1によるc-Fos制御モデルを改変したものです。STAT3シグナルで速やかに誘導されたUBR1がc-Fosを細胞質に留め、ユビキチン化をおこし分解を促進しますが、ERK5が持続的に活性化されていいると、c-FosをSer32とThr232の2ケ所でリン酸化することでc-Fosを核へもたらし、安定化させます。この制御系とは独立して、ユビキチン化を伴わない分解系が核内でc-Fosの分解に働くと考えられ、c-Fosの安定化のためにはERK5によるリン酸化とERK1/2その他のキナーゼによるリン酸化がともにおこることが必要と考えています。
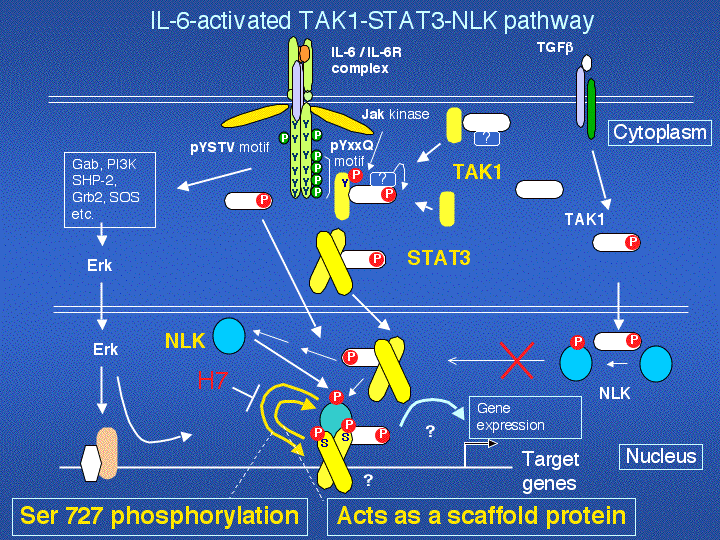
次の図は、gp130のYXXQモチーフに由来するSTAT3 S727キナーゼ系がTAK1-STAT3-NLK系であることを示している。PNAS
2005論文のまとめ。今後明らかにすべき面白い問題が多い。
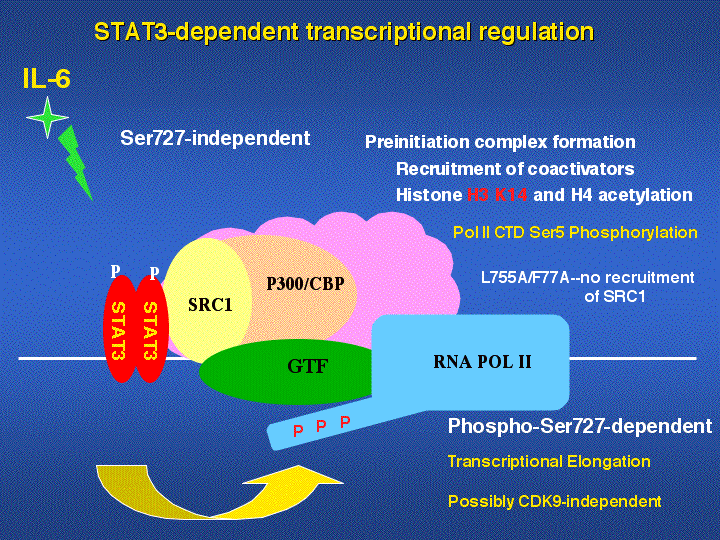
STAT3による転写には、C末にあるTAD(転写活性化ドメイン)が必要だが、TADを含むSTAT3がどのような制御分子群を標的遺伝子プロモーターにリクルートするのか、どのような仕組みで転写開始反応、伸長反応が起こるのかはほとんど明らかではない。そこでSTAT3ノックダウン細胞に様々なSTAT3変異体を導入し、再構成細胞を作成することでその仕組みの解明を行う。まずは、転写活性化ドメインのうち魚からヒトまで高度に保存された752-761領域の役割、リクルートされる分子の同定を行った。STAT3
L755A/F757A変異体は、SRC1をリクルートできず、それに一致してHisone H3 K14のアセチル化が見られなくなる。
UBR1は160 Kbという大きな遺伝子ですが、STAT3依存的に速やかに発現が誘導されます。この速やかな遺伝子発現の機序を明らかにすることで、転写制御系の新たな仕組みがわかると考えています。