ビダーザ臨床試験
高リスク群を対象とした臨床第III相試験-ランダム化非盲検並行群間比較試験-
Fenaux P, et al. Efficacy of azacitidine compared with that of conventional care
regimens in the treatment of higher-risk myelodysplastic syndromes: a
randomised, open-label, phase III study. Lancet Oncol 10: 223-232, 2009ならびに
ビダーザ総合製品情報概要より抜粋
regimens in the treatment of higher-risk myelodysplastic syndromes: a
randomised, open-label, phase III study. Lancet Oncol 10: 223-232, 2009ならびに
ビダーザ総合製品情報概要より抜粋
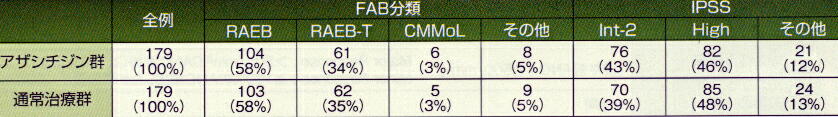
[対象]
高リスク(主としてIPSSのInt-2又はHigh)の骨髄異形成症候群(主としてFAB分類の
RAEB、RAEB-t、CMMoL)の358例。CMMoLについては末梢血単球数1000以上、白血
球数13000以下、骨髄所見で一系統以上の異形成、骨髄芽球10-29%の症例に限っ
た。また造血幹細胞移植を行う見込みのない患者に限った。二次性(治療関連)骨髄異
形成症候群は対象外とした。年齢の中央値は69歳(範囲38-88歳)であった。
RAEB、RAEB-t、CMMoL)の358例。CMMoLについては末梢血単球数1000以上、白血
球数13000以下、骨髄所見で一系統以上の異形成、骨髄芽球10-29%の症例に限っ
た。また造血幹細胞移植を行う見込みのない患者に限った。二次性(治療関連)骨髄異
形成症候群は対象外とした。年齢の中央値は69歳(範囲38-88歳)であった。
[割付]
責任医師がランダム化に先立ち被験者に最適と考えられる通常治療法(支持療法、少
量シタラビン療法、標準化学療法)を選択した。その後、割り付けた各通常治療法ごとに
アザシチジン通常治療法が均等になるようにランダム化した。その結果、アザシチジン
群が179例、通常治療群が179
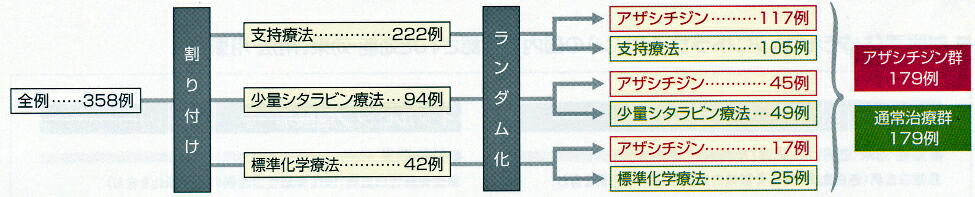
例となった。
量シタラビン療法、標準化学療法)を選択した。その後、割り付けた各通常治療法ごとに
アザシチジン通常治療法が均等になるようにランダム化した。その結果、アザシチジン
群が179例、通常治療群が179

例となった。
[用法・用量と投与期間]
* アザシチジン:75mg/sqを1日1回7日間皮下投与し、3週間休薬する。これを1サイク
ルとし、投与を繰り返した。疾患の増悪や治療継続困難な有害事象の発現が認められ
ない限り投与継続可能とした。最低6サイクルを目標とした。
ルとし、投与を繰り返した。疾患の増悪や治療継続困難な有害事象の発現が認められ
ない限り投与継続可能とした。最低6サイクルを目標とした。
* 支持療法:輸血、抗生物質、G-CSF又はGM-CSF
* 少量シタラビン療法:20mg/sqを14日間投与
* 標準化学療法:シタラビン100-200mg/sq/日を7日間投与+アントラサイクリンを3日
間投与
間投与
[有効性]
アザシチジン75mg/sqを1日1回7日間(28日毎)、中央値で9サイクル(範囲1-39)。
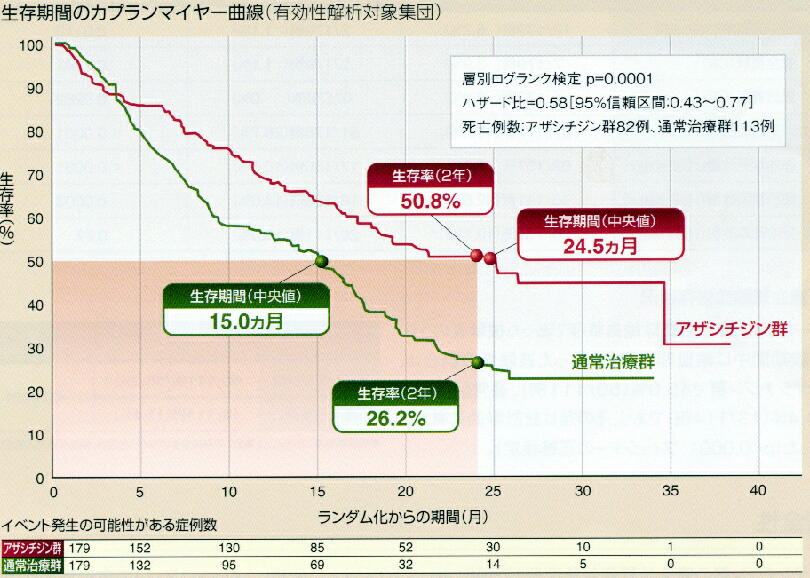
* 生存期間:生存期間中央値は通常治療群で15ヶ月であったのに対して、アザシチジ
ン群では24.5ヶ月であった。アザシチジンによる生存期間の延長は9.4ヶ月であり、死亡
リスクは42%低下した。2年生存率はアザシチジン群が50.8%、通常治療群が26.2%で
ありその差は24.6ポイントであった。
ン群では24.5ヶ月であった。アザシチジンによる生存期間の延長は9.4ヶ月であり、死亡
リスクは42%低下した。2年生存率はアザシチジン群が50.8%、通常治療群が26.2%で
ありその差は24.6ポイントであった。
* AML移行又は死亡までの期間:AML移行又は死亡までの期間(中央値)は通常治療
群で7.6ヶ月であったのに対して、アザシチジン群では13.0ヶ月と有意な延長が認められ
た。アザシチジン群では通常治療群と比較してAML移行又は死亡のリスクが32%低下し
た。
群で7.6ヶ月であったのに対して、アザシチジン群では13.0ヶ月と有意な延長が認められ
た。アザシチジン群では通常治療群と比較してAML移行又は死亡のリスクが32%低下し
た。
* AML移行までの期間:治療期間中に限定したAML移行までの期間(中央値)は通常
治療群で12.4ヶ月であったのに対し、アザシチジン群26.1ヶ月と有意な延長が認められ
た。アザシチジン群では通常治療群と比較してAML移行のリスクが43%低下した。
治療群で12.4ヶ月であったのに対し、アザシチジン群26.1ヶ月と有意な延長が認められ
た。アザシチジン群では通常治療群と比較してAML移行のリスクが43%低下した。
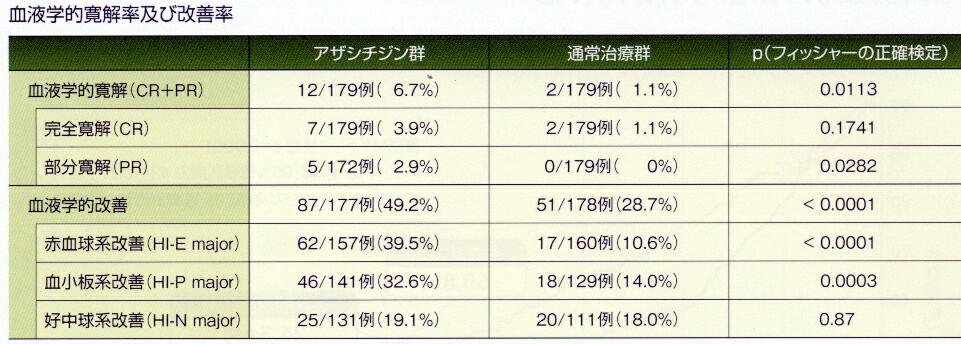
* 血液学的寛解及び改善:血液学的寛解率(完全寛解+部分寛解)はアザシチジン群
7%(12/179例)、通常治療群1%(2/179例)で有意差を認め裸。血液学的改善率はア
ザシチジン群49%、通常値両群29%で有意差を認めた。
7%(12/179例)、通常治療群1%(2/179例)で有意差を認め裸。血液学的改善率はア
ザシチジン群49%、通常値両群29%で有意差を認めた。
* 赤血球輸血依存状況:ベースライン時に赤血球輸血依存であった被験者のうち、試
験期間中に輸血非依存性となった被験者の割合はアザシチジン群で45%(50/111例)、
通常治療群で11.4%(13/114例)であり、その差は統計学的に有意であった。
験期間中に輸血非依存性となった被験者の割合はアザシチジン群で45%(50/111例)、
通常治療群で11.4%(13/114例)であり、その差は統計学的に有意であった。
[安全性]
アザシチジン群の安全性評価対象症例175例において10%以上に発現したgrade3又は
4の有害事象は好中球減少症107例(61.1%)、血小板減少症102例(58.3%)、白血球
減少症26例(14.9%)、貧血24例(13.7%)、発熱性好中球減少症22例(12.6例)、急性
骨髄性白血病28例(16.0 %)、肺炎18例(10.3%)であった。
4の有害事象は好中球減少症107例(61.1%)、血小板減少症102例(58.3%)、白血球
減少症26例(14.9%)、貧血24例(13.7%)、発熱性好中球減少症22例(12.6例)、急性
骨髄性白血病28例(16.0 %)、肺炎18例(10.3%)であった。
通常治療群の安全性評価対象症例165例において10%以上に発現したgrade3又は4の
有害事象は好中球減少症46例(27.8%)、血小板減少症62例(37.5%)、急性骨髄性白
血病38例(23.0%)、貧血20例(12.1%)であった。
有害事象は好中球減少症46例(27.8%)、血小板減少症62例(37.5%)、急性骨髄性白
血病38例(23.0%)、貧血20例(12.1%)であった。
|
|

