ユビキチン修飾系とは?
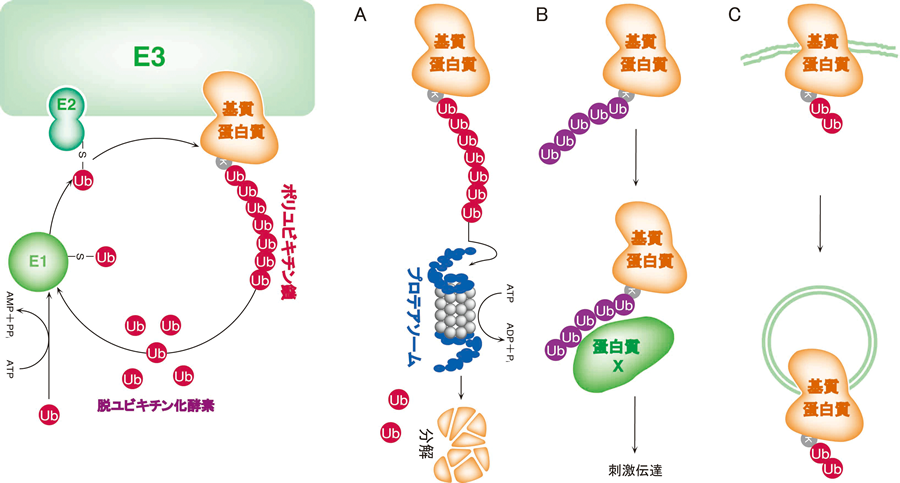
図1 ユビキチン修飾系の概略
ユビキチン修飾系はE1(活性化酵素)/E2(結合酵素)/E3(ユビキチンリガーゼ)の3種の酵素群の働きにより、標的タンパク質にユビキチンを結合させる翻訳後修飾系であり、多くの場合は連続的にユビキチンが結合することで生じるポリユビキチン鎖が指標となりタンパク質の機能を制御する。ユビキチンの48番目のリジン(K48)を介したポリユビキチン鎖は標的タンパク質のプロテアソームによる分解シグナルとなるが(A)、K63を介したポリユビキチン鎖はタンパク質結合ドメインとして機能し、シグナル伝達やDNA修復に関与する(B)。モノまたはジユビキチンがタンパク質の内在化シグナルとなることも知られている(C)。 |
|
ユビキチン修飾系は1978年にエネルギー依存的タンパク質分解系の一部として発見された、タンパク質翻訳後修飾系です。ユビキチンは76アミノ酸からなる酵母からヒトに至るまで非常に良く保存された小タンパク質です。ユビキチンはC末のグリシン残基でATP依存性にE1(ユビキチン活性化酵素)のシステイン残基と結合した後、E1からE2(ユビキチン結合酵素)に転移され、E3(ユビキチンリガーゼ)によって認識される標的タンパク質のリジン側鎖のe-アミノ基にイソペプチド結合し、ユビキチン化されたタンパク質の機能を制御します。
多くの場合、標的タンパク質に連続的にユビキチンが結合したポリユビキチン鎖によってその機能が制御されます。タンパク質分解へと至る場合には、標的タンパク質のリシン残基に結合したユビキチンの48番目のリシン残基にユビキチンのC末端がイソペプチド結合を繰り返すことにより,ポリユビキチン鎖が形成されます。このリジン48(K48)を介して形成されたポリユビキチン鎖が26Sプロテアソームの調節サブユニットによる認識シグナルとして機能し、ユビキチン化されたタンパク質はプロテアソームにより分解されます。
ユビキチンを基質タンパク質から取り除く脱ユビキチン化酵素も数多く同定されていることや、ユビキチン修飾が成長因子受容体などのリガンド依存的な内在化シグナル、タンパク質の局在化シグナルとして機能することなど、ユビキチン修飾系のタンパク質分解以外の新たな生理的機能が続々と明らかとなりつつあります。それゆえ、現在ではユビキチン修飾系はタンパク質分解のみならず、広くタンパク質機能を制御する可逆的なタンパク質修飾システムとして位置付けられています。
私たちの研究テーマ
ユビキチンシステムによる細胞機能制御メカニズムの解析:
a. ユビキチン修飾系による選択的な基質識別メカニズム
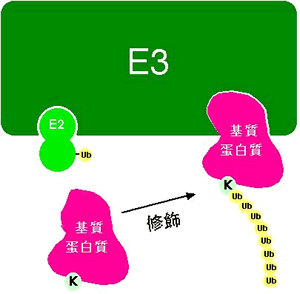
図2 ユビキチン修飾系による選択的な基質識別
ユビキチン系が生体制御において重要な役割を担うのは、生体内に数100種類存在すると考えられているE3:ユビキチンリガーゼが、時を得て選択的に標的たんぱく質を識別出来ることによる。E3による選択的識別には標的たんぱく質の翻訳後修飾が重要な役割を果たしていることが知られている。 |
ユビキチン修飾系の生理学的重要性はE3:ユビキチンリガーゼによる状況に応じた選択的な基質識別に依存しており、その研究が現在のユビキチン研究の大きな焦点となっています。その識別には、基質タンパク質の修飾がシグナルとして機能することが明らかになっており、その修飾を理解することがユビキチン修飾系の生理学的役割の理解の上で重要です。そのようなタンパク質の翻訳後修飾としてはリン酸化が良く知られています。私たちはユビキチン修飾系の選択的基質認識メカニズムに興味を思って研究を進め、タンパク質の酸化修飾もそのシグナルとして機能することを示して来ました。酸化タンパク質を選択的に識別するユビキチンリガーゼの同定に成功し、現在はその機能解析を進めています。
b. ユビキチン修飾系の異常によるガン、神経変性疾患の発症メカニズム
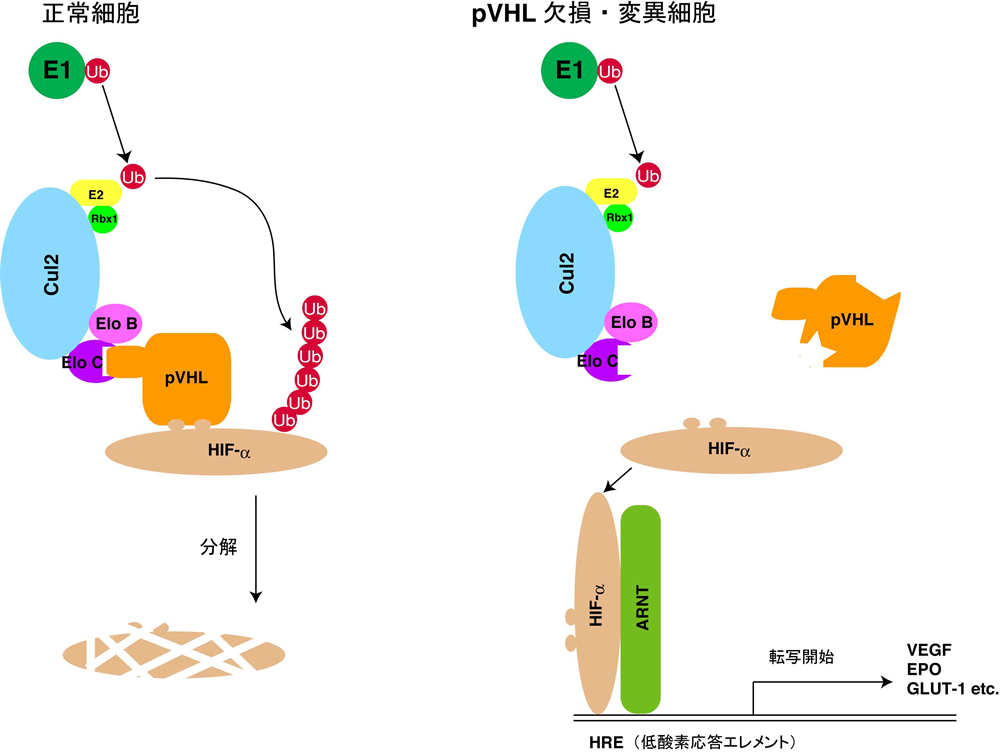
図3 VHL欠損による発ガンメカニズムの一端
VHLは80%以上の散発性の腎透明細胞ガンにおいて欠損または発現抑制が報告されているガン抑制性遺伝子である。pVHLはVBC-Cul2ユビキチンリガーゼの基質認識サブユニットとして機能しており、低酸素応答性転写因子であるHIF-aを酸素依存性にユビキチン化する。すなわち、VHL欠損により、細胞は正常酸素分圧化でもあたかも低酸素状態に感じてしまうことで発ガンの引き金が引かれる。 |
VHL遺伝子はvon Hippel-Lindau(VHL)病の原因遺伝子として1993年に同定されました。VHL病は腎細胞癌、褐色細胞腫、網膜の血管腫、中枢神経系の血管芽腫など種々の良性悪性腫瘍により特徴づけられる常染色体優性遺伝性疾患です。また、VHLは80%以上の散発性の腎淡明細胞癌や小脳の血管芽腫においても欠損または発現抑制が報告されている癌抑制性遺伝子です。VHL遺伝子の産物pVHLはelonginB/C,
Cullin2, Rbx1とVBC-Cul2複合体を形成することが知られていました。私たちはVBC-Cul2複合体がユビキチンリガーゼ活性を有しており,pVHLはその基質認識サブユニットとして機能していることを示し、ユビキチン修飾系の分子の異常が発ガンの引き金を弾くとの知見を初めて明らかにしました。
さらに、VBC-Cul2リガーゼが低酸素応答性転写因子であるHIF-aを酸素依存性にユビキチン修飾するリガーゼであることを示し,pVHL欠損により、細胞が正常酸素状態でもあたかも低酸素であるかのように感じることがガン化に引き金を引くことを明らかにしました。VBC-Cul2リガーゼはプロリン残基がヒドロキシル化されたHIF-aを選択的に識別されることが報告されています。
高酸素分圧下でのHIF-aの半減期は約5分と非常に短いことが知られています。私たちは現在、VBC-Cul2リガーゼによるHIF-aのユビキチン依存性分解系をモデル系として、標的タンパク質のユビキチン化からプロテアソームによる分解に至るまでの経路に関して詳細に解析を進めています。
また、私たちが新たに同定したユビキチンリガーゼが発ガンと密接に関わっていることが明らかになってきましたので、現在はそのリガーゼとによる発ガン機構に関しての研究を進めています。
さらに、順天堂大学の水野美邦教授・東京都臨床研の田中啓二所長代行らと若年型家族性パーキンソン病の原因遺伝子産物parkinがユビキチンリガーゼであることを明らかにしました。
c. 新規ポリユビキチン鎖によって制御される生命現象、タンパク質機能の解析
先にも述べましたが、ユビキチン修飾系の大きな特徴は標的タンパク質に結合するユビキチンは1つではなく、結合したユビキチンにユビキチンが付加することにより形成されるポリユビキチン鎖によって標的タンパク質の機能を制御する場合が多い点にあります。私たちが新たに同定したユビキチンリガーゼはこれまでのユビキチン研究の概念を超越したポリユビキチン鎖を形成することが明らかとなり、現在そのポリユビキチン鎖によって制御される生命現象、タンパク質機能の研究を精力的に進めています。