研究グループ:研究内容
大腸がん微小環境研究グループリーダー:笠島 裕明
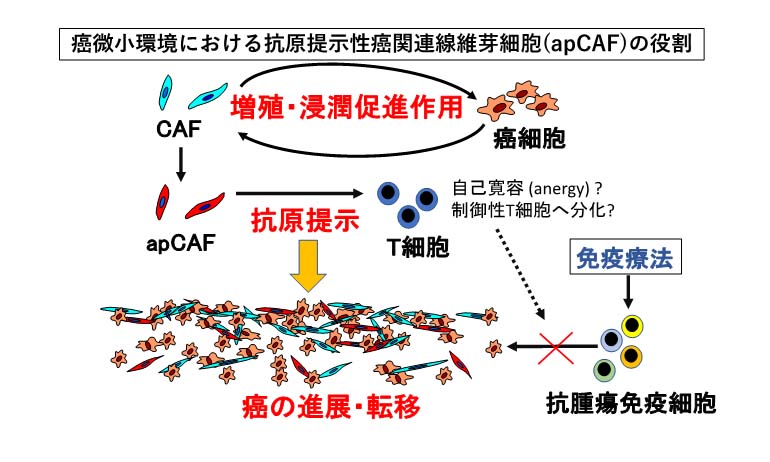
近年、大腸がんは既存の遺伝子発現パターンに基づく大腸がん分子サブタイプ分類(Consensus molecular subtyping;CMS分類)が提唱され、中でも癌関連線維芽細胞(Cancer-associated fibroblast;CAF)の集積を特徴とする間葉型(CMS4)の予後は極めて不良と報告されています。さらに、CAFの中でも抗原提示能を持つCAF(Antigen-presenting CAF; apCAF)の存在が報告されており、腫瘍免疫に影響を及ぼす可能性が示唆されています。このようにがん微小環境に存在する細胞(がん間質細胞)ががん細胞との相互作用を通してがんの進展に関与することが明らかになってきています。本研究の目的は、がん間質細胞、特にCAFによる腫瘍免疫応答調節メカニズムの解明及び大腸癌新規治療法の開発に寄与することです。
エクソソーム癌微小環境研究グループリーダー:杉本 敦史
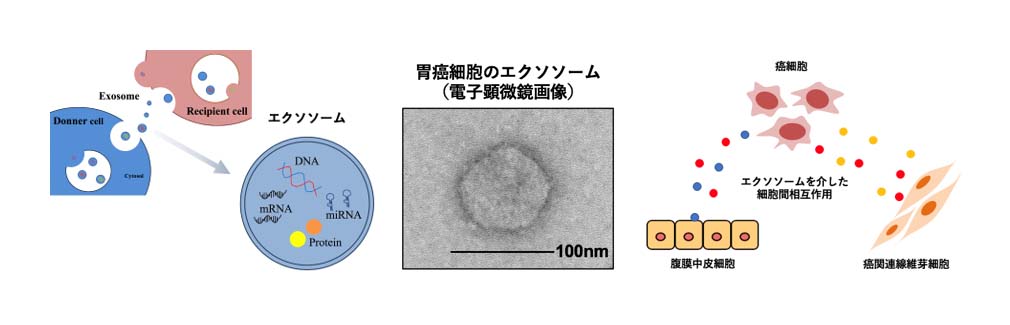
スキルス胃癌は腹膜転移を来す頻度が高く、極めて予後不良な難治癌の一つです。我々は、スキルス胃癌細胞から産生される因子が癌細胞周囲の微小環境を癌にとって増殖や転移するのに都合の良い環境に変化させていることを明らかにしてきました。しかしながら、腹膜転移形成のメカニズムについては十分に解明されたとは言えません。近年、exosome(エクソソーム)と呼ばれる細胞外小胞があらゆる細胞から分泌され、細胞間のコミュニケーションに用いられていることが分かってきました。エクソソームの中にはDNA、RNA、タンパク質などが内包されており、癌細胞周囲の微小環境における細胞間相互作用に関与していることが報告されています。今後、エクソソームへの理解が深まることで、癌進行メカニズムの解明、さらには新規癌治療法や診断法の開発が期待されています。我々の研究室ではこれまで、癌関連線維芽細胞の分泌するエクソソームが、スキルス胃癌細胞の遊走能を促進することを報告しています。さらに、腹膜中皮細胞の分泌するエクソソームがスキルス胃癌細胞の遊走浸潤能を促進していることも分かってきました。現在はエクソソームに内包されている分子を解析し、スキルス胃癌の進行に寄与する分子の臨床病理学的意義の解明、およびエクソソームを標的としたスキルス胃癌の腹膜転移制御法の探索を目的として研究を行っています。
スキルス胃癌遺伝子解析研究グループリーダー:瀬良 知央
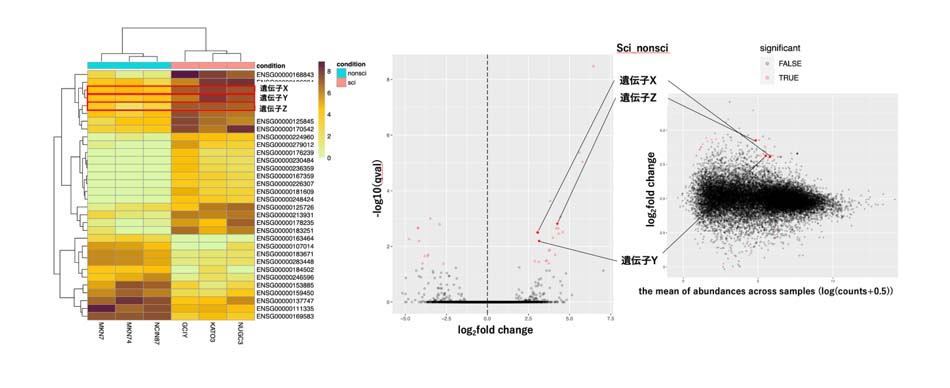
スキルス胃癌は極めて悪性度の高い難治がんであり、これまで有効な分子標的治療薬がなく日本の保健衛生に重大な影響を及ぼしています。一方、近年では特定の癌に対する分子標的治療薬が開発されており、次世代シークエンサー等の発達がその流れを加速させています。次世代シーケンシングは数千から数百万ものDNA分子を同時に配列決定可能な強力な基盤技術です。私の研究では当教室独自のスキルス胃癌細胞株からRNAを抽出し、当教室の次世代シークエンサー(Ion GeneStudio S5 system)にてRNA-seqを行い、新規ドライバー遺伝子を探索しております。RNA-Seqにより細胞の中のmRNAやmiRNAの配列を解読して、発現量の定量、新規転写配列の発見ができます。その得られたシークエンスデータを世界のがんゲノムデータベースを用いてin silico analysisを行うことで様々なデータと比較検討することが可能となり、さらに広い視野で研究を行っております。
CXCL1-CXCR2シグナル阻害剤による難治癌治療薬開発研究グループリーダー:山本 百合恵
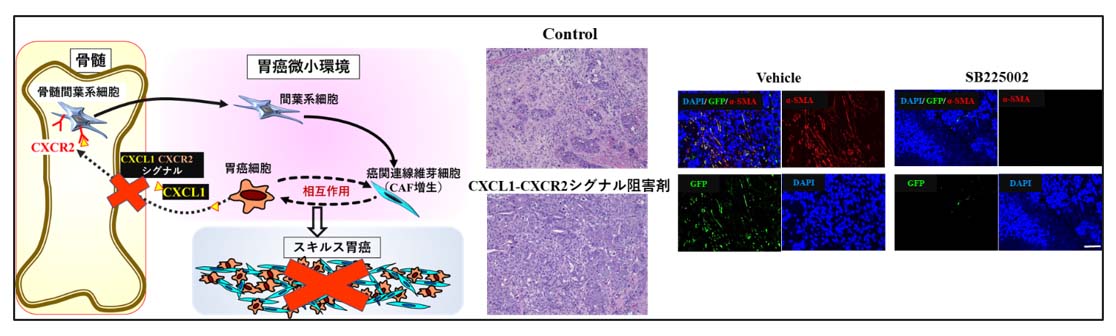
スキルス胃癌間質組織の増生を伴いながら急速に増殖進展し、予後不良な難治性の癌です。スキルス胃癌間質の存在する癌関連線維芽細胞(CAF)は癌細胞との相互作用によりスキルス胃癌増殖進展の一因となることが明らかになってきました。また近年、このCAF増生がスキルス胃癌のみならず、種々の固形癌の難治性の一因として考えられています。これまでに我々の教室ではCXCL1-CXCR2シグナルがCAF増生に関与する分子であることを明らかにしてきました。これらの機序をもとに、スキルス胃癌や胆道癌、膵癌などの難治癌の新規治療薬の開発研究に取り組んでいます。
腫瘍内不均一性と抗癌剤耐性研究グループリーダー:辻尾 元
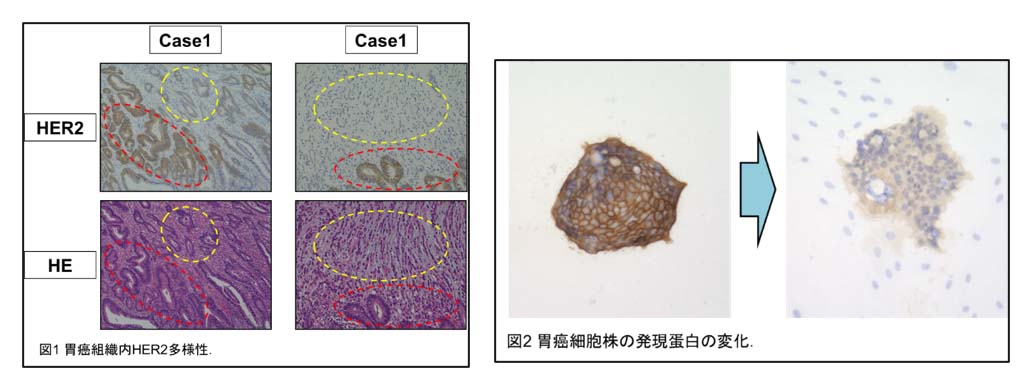
癌組織は病理学的および分子生物学的に多様性(不均一性)を示します。なかでも胃癌はHER2など様々な癌関連分子の腫瘍内多様性が高頻度に見られ、抗癌剤不応性や耐性に関与していると考えられます。しかしながら、胃癌腫瘍内多様性と治療抵抗性との関連性や不均一性の獲得機序については解明されていません。そこで我々は胃癌腫瘍内不均一性の組み合わせの解明および不均一性の原因の解明に向けた研究を行っております。腫瘍内不均一性の組み合わせに関しましてはクラスター解析を用い腫瘍内不均一性の組み合わせのグループ分けを行い、抗癌剤の感受性を明らかにすることで新規併用療法の開発を目指しております。腫瘍内不均一性の原因に関しましては我々は癌細胞のみならず周囲微小環境にあると考えており、実際に胃癌細胞株と癌関連線維芽細胞との相互作用にて胃癌細胞株の発現蛋白に変化が生じていることを確認しております。そこで我々は、癌細胞の腫瘍内不均一性を引き起こす原因物質の発見を目指し、さらには新規治療法の開発を目的とし研究を行っております。
難治癌リキッドバイオプシー開発研究グループリーダー:丸尾 晃司
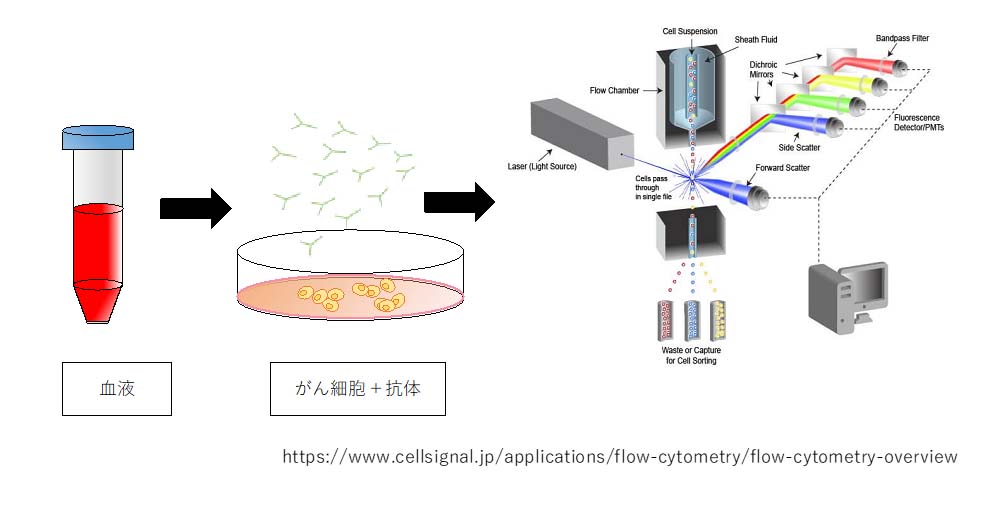
がん細胞がもっている特定の遺伝子やタンパク質をターゲットとして作用する分子標的薬開発が進んでおり、がん治療成績の向上に寄与しています。我々の研究グループは、それらの遺伝子やタンパク質をターゲットとして患者血液中の癌細胞の同定方法を開発し、難治癌診断や治療予測に有用か明らかにすることを目指します。本研究により血液中から癌細胞の検出手技が確立し、難治癌診断としての有用性が明らかにされれば、根治手術可能な症例が増加し、難治癌の治療成績向上に貢献すると期待しています。
難治性胃癌微小環境研究グループリーダー:佐久間 崇
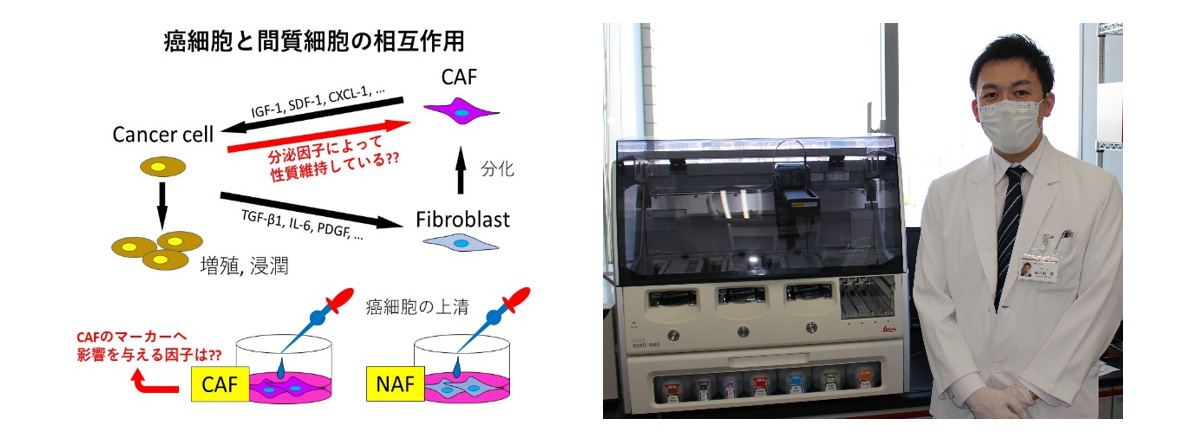
難治癌の一つであるスキルス胃癌では,癌間質において癌関連線維芽細胞(Cancer associated fibroblast; CAF)から様々なサイトカインやタンパク質が誘導され,癌細胞の進展や悪性化に密接に関与しています.癌細胞と間質細胞(CAFを含む)との間には,液性因子によるオートクラインシグナルの活性化のような間接的相互作用に加えて,上皮間葉転換後の浸潤のような直接的相互作用が働き,癌化を促進します.その詳細な機序や役割は未だ不明な点が多いですが,このような相互作用の背景から一つの仮説として,スキルス胃癌細胞からの産生物質によってCAFの性質が維持,制御されているのではないかと考えられます.我々の研究では,癌細胞の上清を用いることでその因子を同定し,その病態に基づいたスキルス胃癌制御法の探索,そして新規治療法開発を目標に取り組んでいます。
脳腫瘍研究グループリーダー:青山 里佳
脳腫瘍の中でも神経膠芽腫は、高度に脳組織内を浸潤するため極めて予後不良です。神経膠芽腫の「腫瘍微小環境」において、脳間質細胞から産生されるAngiopoietin-2が膠芽腫細胞のTie2受容体に作用し浸潤能を促進していることが明らかになっています。そこで、Angiopoietin2/Tie2シグナル阻害剤による脳腫瘍抑制効果をin vitroおよびin vivoで解析し、脳腫瘍に対する治療薬の新規開発を目指しています。
また神経膠芽腫を含めた難治癌における「がん遺伝子パネル検査」の臨床的意義を解析しています。具体的には、Foundation-one CDx、NCC オンコパネルを分析し、難治癌患者治療の有効性を検討しています。特に小児脳腫瘍の中で悪性度の高い神経膠腫については、NGSのin silico解析を加えての治療薬の探索を行う予定で、この検討で小児脳腫瘍患者の予後向上に貢献したいと思います。

胆嚢癌におけるERBB4シグナルの意義解明およびERBB4を標的とした新規治療法の研究グループリーダー:王強
胆嚢癌や胆管癌などの胆道癌は極めて予後不良のため、有用な治療法の開発が急務とされています。胆嚢癌細胞の約20%に上皮成長因子受容体(EGFR)ファミリーのERBB4が過剰発現しているとされていますが、ERBB4の過剰発現の臨床的意義は十分には明らかにされていません。我々は、ERBB4が高発現する胆嚢癌細胞株を樹立し、この細胞を含めた胆嚢癌細胞株数種を用いて、胆嚢癌におけるERBB4シグナルの意義を研究し、ERBB4を標的とした新規治療法開発に取り組んでいます。

間質反応強いCMS4型大腸癌およびスキルス胃癌の分子生物学的研究グループリーダー:範燦鋒
大腸癌の約30%を占め鋸歯状腺癌は大腸癌の1亜型であり、多型に比し悪性度が高いとされています。鋸歯状腺腫あるいは上皮過形成が鋸歯状腺癌の前駆病変と推察されていますが未だ明らかではありません。一方、大腸癌は、その遺伝子発現プロファイリングに基づいて4種の分子サブタイプ(CMS)に分類されており、我々は悪性度が高いCMS4型腫瘍と鋸歯状腺腫(上皮過形成)-鋸歯状腺癌の発癌経路の相関関係を分子生物学的に検討しています。また、胃癌の1亜型であるスキルス胃癌は間質成分の多い悪性度が極めて高い胃癌亜型であり、スキルス胃癌と間質反応強いCMS4型腫瘍との相関関連性を分子生物学的に検討しています。
留学
- 杉本 敦史
(Columbia University Digestive and Liver Diseases Research Center, New York:米国 2022年4月~) - 西村 貞德
(Weill Cornell Medicine, Rockefeller University Campus, New York:米国 2021年5月~)
留学報告記
笠島裕明
米国Moscat lab:https://www.moscatdiazmecolab.org 2016年7月~2020年9月
- Sanford Burnham Prebys Medical Discovery Institute (San Diego, CA)
- Weill Cornell Medical College (New York, NY)
私は、2016年7月から2020年9月までMoscat labにPostdoctoral fellowとして留学させて頂きました。幸運にもラボの移動に合わせてカリフォルニア州サンディエゴにあるSanford Burnham Prebys Medical Discovery Instituteと、ニューヨークマンハッタンにあるWeill Cornell Medical Collegeで働くことができたため、西海岸・東海岸の両方で生活する経験ができました。もちろん留学は第一線の研究を行うという目的が第一ですが、それとともに異文化に触れ、日本では出会うことのできなかったであろう人々と交流することで人生が大きく変わったと感じることができました。留学で得た知識・経験と友人達を大切にこれからの医師人生に生かしていければと思います。

西村貞德
2021年5月から米国コーネル大学医学部(Weill Cornell Medicine)に留学中の西村貞德です。このコーネル大学はアメリカのハーバード大学やコロンビア大学が属するIVY Leagueの中の1大学であり、その医学部はニューヨーク・マンハッタンの大都会に位置しています。ここでDr. Jorge Moscat & Dr. Maria T. Diaz-Mecoの下でポスドクとして働いております。このラボはポスドクと大学院生で15人以上在籍するビッグラボであり、世界各国から優秀な研究者が集まって、日々研鑽を積んでおります。研究テーマとして主に大腸癌、前立腺癌、肝臓癌の癌微小環境を扱っており、小生はその中でも肝細胞癌の抗腫瘍免疫における因子に関して研究しております。
ニューヨークでの生活と聞けば、・物価が高い・家賃が高い・銃犯罪が多い、などが思い浮かぶかもしれませんが、コーネル大学はマンハッタン横にある小さな島、Roosevelt islandに寮を持っており、大半のポスドクがここで暮らしております。この寮はマンハッタンのマンションに比べて比較的安い賃料であり、マンハッタンまで地下鉄で一駅であり、何より犯罪がほぼない日本人でも住みやすい街となっております。
研究以外にもやはり留学生活を楽しむためには娯楽も大事ですが、そこは世界の中心ニューヨーク。ご存知の通りブロードウェイ、美術館、スポーツ観戦などありとあらゆる魅力的なスポットが、遊び尽くせないぐらい集まっております。
留学して約1年が経ち、最初は慣れないことがたくさんあり大変なことが多かったのですが、だいぶ生活にも慣れて、現在取り組んでいる研究テーマを完遂することを目標に日々充実した毎日を送っております。またまだ聞きたいことがあればsan4005[at]med.cornell.eduまで連絡ください。


大阪公立大学大学院医学研究科倫理委員会承認研究課題
- 消化器腫瘍の増殖進展における遺伝子異常の解析
- 乳腺・内分泌腫瘍の増殖進展における遺伝子異常の解析
- 腫瘍の増殖進展に関与する脂質系シグナルの解析-多施設参加臨床研究-
- 消化器癌における腫瘍増殖に影響する因子の発現解析
- 組織アレイの作成
- 悪性腫瘍の増殖・進展に影響する因子の発現解析-多施設参加臨床研究-
- 消化器腫瘍患者における血中循環腫瘍細胞の検討
- 胃壁捺印細胞診または腹腔洗浄細胞診陽性症例を対象とした術中腹腔内大量洗浄の意義に関する第Ⅱ相試験
- 固形癌に対する腫瘍遺伝子網羅的解析結果に基づく分子標的治療薬選択に関する観察研究
- 進行・再発の難治性固形癌患者に対するOncomine Target Testシステムを用いたがん遺伝子パネル検査に関する研究-多施設参加共同研究-
- 固形腫瘍の遺伝子異常の解析研究
- 多種がんに対する核酸バイオマーカーの探索・同定
- 消化器癌組織アレイ作成に基づく、消化器癌における蛋白発現や予後の解析
- がん遺伝子パネル検査結果に基づいた難治癌の遺伝子異常と治療法に関する研究
以上の研究に関しては患者様から文書もしくは口頭で説明・同意を得て、実施をしております。既に研究にご参加頂いている患者様におかれましても研究の拒否をご希望される方は下記までご連絡下さい。
担当者:八代正和 : i21496f[at]omu.ac.jp
また上記の研究とは別に、患者さまへの侵襲や介入もなく診療情報等の情報のみを用い研究や、余った検体のみを用いるような研究については、国が定めた指針に基づき「対象となる患者さまのお一人ずつから直接同意を得る必要はありません」が、研究の目的を含めて、研究の実施についての情報を公開し、さらに拒否の機会を保障することが必要とされております。今後当研究室で行っている研究でオプトアウトを用いた臨床研究についても本ホームページを用いて公開させて頂きます。
研究費(研究代表者)
文部科学省科学研究費
- 2022年度 科研費(基盤研究(C))深海放線菌が産生する新規の胃癌抑制物質の同定
- 2022年度 科研費(若手研究)「腹膜中皮細胞由来エクソソームの解析に基づく胃癌腹膜転移の新規治療法の開発」
- 日本学術振興会 基盤研究(B)2021年度~2023年度 ヒト化CXCL1抗体の癌関連線維芽細胞(CAF)抑制作用によるスキルス胃癌治療 (研究代表者 八代正和)
- 日本学術振興会 若手研究2021年度~2022年度 抗原提示性癌関連線維芽細胞が腫瘍免疫に及ぼす影響の解析と大腸癌免疫治療への応用 (研究代表者 笠島裕明)
- 日本学術振興会 基盤研究(B)2018年度~2021年度 スキルス胃癌組織構築機序の解明と治療開発:骨髄細胞と癌幹細胞による間質形成の解析 (研究代表者 八代正和)
- 日本学術振興会 平成23~26年度 基盤研究(B)低酸素微小環境における胃癌細胞の悪性形質獲得の機序解明と治療標的分子の探索(課題番号:23390329) (研究代表者 八代正和)
- 平成20~22年度 基盤研究(C) スキルス胃癌に対する分子標的治療薬の開発および抗癌剤との併用効果の検討(課題番号:20591573) (研究代表者 八代正和)
- 平成18~19年度 基盤研究(C)KGFR阻害剤およびTGFβR阻害剤を用いた胃癌転移の分子標的治療開発(課題番号:18591475) (研究代表者 八代正和)
- 平成13~16年度 基盤研究(C)胃癌の腹膜播種性転移における周囲微小環境の影響とその分子機構の解析 (課題番号:13671329)
その他の省庁研究補助金
- 2021年度 リゾーム型研究人材育成プログラム(山本百合恵)
- 2021年度 公益財団法人大阪コミュニティ財団「がん研究助成」(山本百合恵:100万円)
- 2021年度 武田科学振興財団 医学系研究助成(研究代表者 笠島裕明)
- 平成22~25年度 がん研究開発費スキルス胃がん研究班. スキルス胃がんの浸潤・播種の機構と新規治療法の研究. キルス胃がん細胞株の樹立。浸潤・播種を制御する分子/薬剤の検索 財団等補助金
- 平成29年度 戦略的研究 基盤研究 大阪公立大学 ススキルス胃癌細胞と癌関連線維芽細胞との相互作用に関わるシグナルの解明と新規治療法の開発
- 平成26年度 戦略的研究 重点研究(B) 大阪公立大学 スキルス胃癌に対する分子標的治療薬の新規開発
- 平成23年度新産業創生研究 大阪公立大学 難治癌の増殖進展に関与する脂質系分子メカニズムの解明と阻害剤の開発
- 平成20年度 住友信託銀行公益信託 外科学研究助成金 FGF受容体阻害剤およびTGFβ受容体阻害剤を用いた胃癌転移に対する分子標的治療の開発
- 平成20年度 財団法人大阪癌研究会 一般学術研究助成金 FGFR2 阻害剤およびTGFβ-R阻害剤を用いた胃癌分子標的治療の検討
- 平成19年度 大阪公立大学特定研究奨励費 スキルス胃癌の増殖進展機序の解明と分子標的治療
- 平成19年度 財団法人日本消化器病学会 研究助成 スキルス胃癌の病態に基づいた分子標的治療の開発
- 平成19年度 佐川がん研究助成振興財団 スキルス胃癌の病態解明と分子標的治療の開発
- 平成18年度 大阪難病財団医学研究助成 スキルス胃癌の病態と分子標的治療
- 平成18年度 小林がん学術振興会 スキルス胃癌の腹膜播種性転移およびリンパ節転移に対する分子標的治療の開発
- 平成16年度 大阪公立大学医学振興協会. 医学研究奨励助成 スキルス胃癌のリンパ節転移および腹膜播種性転移の病態解明と治療
共同研究
- 共同研究 (平成25年度) (研究責任者:八代正和)ヒト胃癌細胞株の増殖能の解析
- 共同研究 (平成23~25年度) (研究責任者:八代正和) 難治癌の増殖進展機序解明と分子標的阻害剤の開発
- 共同研究 (平成24~25年度年度) (研究責任者:八代正和), Evaluating anti-tumor efficacy of anti-FGFR2 antibodies in human gastric cancer xenograft models.
- 共同研究 (平成24年度) (研究責任者:八代正和), Analysis of the modifiers of sensitivity to FGFR inhibitors in gastric cancer cells.
- 共同研究 (平成24年度) (研究責任者:八代正和)蛍光標識化OCUM-2MD3およびOCUM-12/Hypoを用いたin vivo同所移植モデル、転移モデル
- 共同研究 (平成23, 24年度) (研究責任者:八代正和)Effect of an FGFR2 antibody on the gastric cancer. Characterization the gastric cancer cells for their in vitro and in vivo prosperities with emphasis on the effect of RTK inhibition on cell signalling and tumor growth.
- 共同研究 (令和4年度) (研究責任者:八代正和)多種がんに対する核酸バイオマーカーの探索・同定
研究費(研究分担者)
文部科学省科学研究費
- 2021年~2022年度 基盤研究(B) -深海性放線菌が生産する天然物に着目したスキルス胃癌を特異的に排除する抗癌剤の開発(研究代表者 坪内泰志)
- 2021年~2023年度 基盤研究(C) -悪性黒色腫の原発巣から産生される転移巣抑制因子の解析と新たな治療法の開発(研究代表者 羽多野隆治)
- 2019年~2022年度 基盤研究(A) -難治癌バイオマーカー同定のためのエクソソーム自動センシングアレイシステムの開発(研究代表者 竹内俊文)
- 2019年~2021年度 基盤研究(C) 難治口腔癌に対するウイルス療法の開発ー免疫チェックポイント阻害剤との併用療法(研究代表者 中原寛和)
- 2019年~2021年度 基盤研究(C) 癌関連線維芽細胞のエクソソームが悪性黒色腫の増殖進展におよぼす影響と阻害剤の開発(研究代表者 元村尚嗣)
- 平成26~29年度 基盤研究(B) -スキルス胃癌の難治性克服: 癌幹細胞のオートファジーと分子標的治療開発(研究代表者 平川弘聖)
- 平成22~25年度 基盤研究(B) スキルス胃癌の病態と治療抵抗性の克服-癌幹細胞を標的として-(研究代表者 平川弘聖)
- 平成19~21年度 基盤研究(C) VEGF受容体およびPDGF受容体をターゲットとした大腸癌の分子標的治療(課題番号:19591556) (研究代表者 山田靖哉)
- 平成19~21年度 基盤研究(C) 膵癌に対する新しい分子標的治療 (課題番号:19591556) (研究代表者 仲田文造)
- 平成18~21年度 基盤研究(B) スキルス胃癌の病態と分子標的治療 (課題番号:18390369) (研究代表者 平川弘聖)
- 平成18~20年度基盤研究(C) TGF-βシグナル伝達抑制によるスキルス胃癌進展抑制と治療への応用 (課題番号:18591476) (研究代表者 井上 透)
- 平成13~16年度 基盤研究(B) スキルス胃癌の腹膜播種性転移およびリンパ節転移の病態解明と治療 (課題番号:13470260) (研究代表者 平川弘聖)
その他の省庁研究補助金
- 平成14~16年度 厚生科学研究費補助金(ヒトゲノム・再生医療等研究事業).国内樹立ヒト細胞系の状況調査と収集に関する研究
- 平成9~15年度 厚生省がん研究助成金(松倉)班 胃癌の発生・進展に関わる要因の把握とその診療への応に関する研究
特許取得状況
-
名称:スキルス性胃癌の治療剤、及び胃癌の予後の予測方法
発明者: 八代正和, 平川弘聖, 笠島裕明、日野雅之、中前博久、中根孝彦
権利者: 公立大学法人大阪公立大学、八代正和, 平川弘聖, 澤田鉄二
出願番号: 特願2015-099228
整理番号: 1356JP
出願年月日: 平成27年 5月14日 -
名称:プロスタグランジンD2合成酵素を利用した消化器癌治療剤
発明者: 八代正和, 平川弘聖, 福岡達成
種類: 特願2013-268465、PCT/JP2007/59986
出願年月日: 2018年 1月26日
特許第6278391号 -
名称:癌患者の腹膜播種転移の可能性を判定するための検査方法、及び検査キット
発明者: 八代正和,、大平雅一、三木友一朗
出願番号: 特願2016-182130
出願年月日: 平成28年 9月16日
国内外の別: 国内特許 -
名称:癌の罹患の有無の判別方法並びに癌の治療及び/又は予防のための医薬組成物
発明者: 間野博行(東京大学)、上野敏秀(東京大学)、崔永林(東京大学)、八代正和
出願番号: 特願2015-168169
番号: P15-0166
出願年月日: 平成27年 8月27日
国内外の別: 国内特許
-
名称:TGF-βシグナル阻害剤と抗腫瘍剤の組み合せ使用
発明者: 片岡一則:東京大学, 宮園浩平:東京大学, 狩野光伸:東京大学, 平川弘聖:大阪公立大学, 八代正和:大阪公立大学, 野出 學:京都薬科大学, Bae Younsoo:東京大学,西山伸宏:東京大学
権利者: 科学技術振興機構
種類: 国際特許
整理番号: JP2006-317593 特願2006-24843、特願2006-24845
出願年月日: 2006年 8月30日
国内外の別: 国際特許
-
名称:プライマー、腫瘍マーカーおよび癌の検出方法
発明者: 八代正和, 平川弘聖, 澤田鉄二
権利者: 財団法人大阪産業振興機構、八代正和, 平川弘聖, 澤田鉄二
種類: 国際特許C12N 15/09
整理番号: PCT/JP2007/59986
出願年月日: 2007年 5月15日
国内外の別: 国内特許



