 |
 |
はじめに
原発性骨髄線維症は骨髄の広範な線維化と骨硬化、髄外造血を特徴とする慢性骨髄
増殖性疾患の一つです。その本態は本態性血小板血症、真性多血症と同様に造血幹
細胞レベルで生じた遺伝子異常であり、造血細胞はモノクローナルに増殖、特に血小板
産生細胞である巨核球から産生される種々のサイトカインが骨髄の間質細胞に作用し
て、骨髄の線維化、骨硬化、血管新生などの反応性のポリクローナルな骨髄間質細胞
の増殖が生じます。
増殖性疾患の一つです。その本態は本態性血小板血症、真性多血症と同様に造血幹
細胞レベルで生じた遺伝子異常であり、造血細胞はモノクローナルに増殖、特に血小板
産生細胞である巨核球から産生される種々のサイトカインが骨髄の間質細胞に作用し
て、骨髄の線維化、骨硬化、血管新生などの反応性のポリクローナルな骨髄間質細胞
の増殖が生じます。
病態
真性多血症、本態性血小板血症と同様に骨髄線維症においてもサイトカインのシグナ
ル伝達に必須であるチロシンキナーゼであるJAK2に35-57%の頻度で異常が認められ
ます。JAK2に遺伝子変異が生じると本来はエリスロポイエチン(赤血球増加因子)、トロ
ンボポイエチン(血小板増加因子)などのサイトカインの刺激に応じて活性化される
JAK2が、これらの刺激がない状態でも常に刺激を受け、細胞は自立的な増殖は行うこ
ととなります。また少数の症例(4-5%)ではトロンボポイエチンのレセプターであるc-mpl
という遺伝子に変異が見られ(Ref 1)、JAK2と同様に細胞が自律増殖するようになりま
す。血小板産生細胞の巨核球を中心とした造血細胞が増加することによって、これらの
細胞から産生されるtransforming growth factor(TGF-β)が増加し、線維化の中心的
な役割を果たします。また巨核球や骨髄間質細胞から産生されるosteoprotegerin
(OPG)が骨硬化に関与している可能性が示唆されています(Ref 2,Ref 3,Ref 4)。
ル伝達に必須であるチロシンキナーゼであるJAK2に35-57%の頻度で異常が認められ
ます。JAK2に遺伝子変異が生じると本来はエリスロポイエチン(赤血球増加因子)、トロ
ンボポイエチン(血小板増加因子)などのサイトカインの刺激に応じて活性化される
JAK2が、これらの刺激がない状態でも常に刺激を受け、細胞は自立的な増殖は行うこ
ととなります。また少数の症例(4-5%)ではトロンボポイエチンのレセプターであるc-mpl
という遺伝子に変異が見られ(Ref 1)、JAK2と同様に細胞が自律増殖するようになりま
す。血小板産生細胞の巨核球を中心とした造血細胞が増加することによって、これらの
細胞から産生されるtransforming growth factor(TGF-β)が増加し、線維化の中心的
な役割を果たします。また巨核球や骨髄間質細胞から産生されるosteoprotegerin
(OPG)が骨硬化に関与している可能性が示唆されています(Ref 2,Ref 3,Ref 4)。
臨床像
原発性骨髄線維症の病初期には骨髄生検は過形成ですが、線維化はほとんど認めら
れず、顆粒球系の細胞と巨核球が増加し、赤芽球系が減少しております。この時期を前
線維化期と言います。進行すると細胞成分が減少し、線維化が著明となってきます。
1997年に本邦における骨髄線維症の実態調査が行われました(Ref 5)。新規発症症例
は年間60-70例であり、年齢中央値は65歳、男性に多く認められます。約30-40%の症
例が臨床症状を欠き、偶然の機会に発見されますが、60-70%は何らかの臨床症状で
医療機関に受診した際に発見されます。
れず、顆粒球系の細胞と巨核球が増加し、赤芽球系が減少しております。この時期を前
線維化期と言います。進行すると細胞成分が減少し、線維化が著明となってきます。
1997年に本邦における骨髄線維症の実態調査が行われました(Ref 5)。新規発症症例
は年間60-70例であり、年齢中央値は65歳、男性に多く認められます。約30-40%の症
例が臨床症状を欠き、偶然の機会に発見されますが、60-70%は何らかの臨床症状で
医療機関に受診した際に発見されます。
症状(Ref 5)
症状としては動悸、息切れ、全身倦怠感などの貧血症状を40-50%、脾腫による腹部
膨満感などの腹部症状を10-20%、発熱・全身倦怠感を10%に認めます。
膨満感などの腹部症状を10-20%、発熱・全身倦怠感を10%に認めます。
検査所見
理学的検査
脾腫が86%、肝腫が55%に認められます。
血液検査
ヘモグロビン10g/dl未満の貧血(70%)、10万/μl未満の血小板数減少(32%)、逆に
50万/μl以上の血小板増加(24%)に認められます。
50万/μl以上の血小板増加(24%)に認められます。
末梢血塗抹標本では健常人では見ることができない赤芽球(87%)、巨大血小板
(44%)、涙滴赤血球(69%)、骨髄芽球(62%)を見ることができます。末梢血中に赤芽
球、骨髄芽球が認められる現象は白赤芽球症と称されます。
(44%)、涙滴赤血球(69%)、骨髄芽球(62%)を見ることができます。末梢血中に赤芽
球、骨髄芽球が認められる現象は白赤芽球症と称されます。
染色体検査は末梢血でも可能であり(分裂細胞を得ること可能)、染色体分析が可能
であった症例の42%に核型異常が認められています。骨髄線維症に特異的な染色体異
常は認められず、複雑核型、del(20)、del(13)、trisomy 8などの慢性骨髄増殖性疾患に
高頻度に見られる染色体異常が見られます。
であった症例の42%に核型異常が認められています。骨髄線維症に特異的な染色体異
常は認められず、複雑核型、del(20)、del(13)、trisomy 8などの慢性骨髄増殖性疾患に
高頻度に見られる染色体異常が見られます。
1.臨床所見として
*徐々に進行する貧血と肝脾腫を認める.
*ときに出血傾向、腹部膨満感、発熱、全身倦怠感、体重減少を認める.
*進行すると門脈圧亢進、腹水をきたす.
|
| 2.以下の検査所見を認める。 *末梢血で白赤芽球症、涙滴赤血球などの奇形赤血球、芽球、巨大血小板、巨核球の出現をみる.
*他に原因を認めない血清LDHの上昇.
*画像検査で著明な肝脾腫を認める.
*骨髄シンチグラフィーで、肝脾への取り込み増加を認める.
*骨髄穿刺で骨髄液を採取できない(dry tap).
|
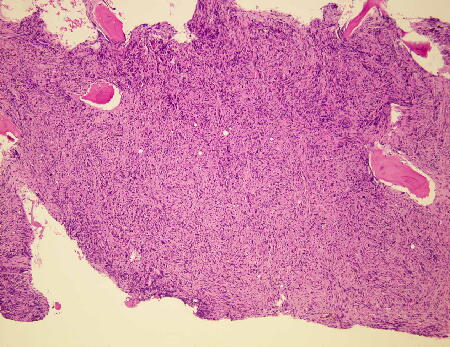
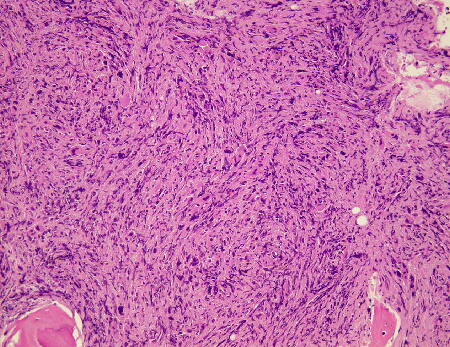
| 3.骨髄生検で異型巨核球増加と骨髄の線維化、骨梁の増加を認める. |
| 4.二次性骨髄線維症を除外する. 二次性骨髄線維症の原因となる疾患急性骨髄性白血病、急性リンパ性白血病、慢性骨髄性白血病、真性赤血球増加症(真性多血症)、原発性血小板血症(本態性血小板血症)、骨髄異形成症候群、多発性骨髄腫、悪性リンパ腫、がん腫、全身性エリテマトーデス、全身性進行性硬化症、放射線照射後、などが含まれる. |
| 診断に際しては 1、2によって原発性骨髄線維症を疑い、 3によって骨髄の線維化を確認する. 4によって二次性骨髄線維症を除外し、診断を更に確実なものとする. |
参考
1)胸腰椎MRIで脂肪の減少、骨硬化を認める。
2)末梢血にCD34陽性細胞、CD41陽性細胞の増加を認める。
3)末梢血を用いた染色体検査で30-50%の症例で染色体異常を認める。
|
治療
現在の医療では原発性骨髄線維症は造血幹細胞レベルで生じる疾患であるため薬物
療法による治癒は困難であり、治癒が可能な治療法は同種造血幹細胞移植となりま
す。しかしながら本疾患の平均生存期間が約10年と経過が緩やかな症例が多く、また平
均発症年齢が65歳と高齢であることより同種造血幹細胞移植の適応となる症例が限ら
れてきます。
療法による治癒は困難であり、治癒が可能な治療法は同種造血幹細胞移植となりま
す。しかしながら本疾患の平均生存期間が約10年と経過が緩やかな症例が多く、また平
均発症年齢が65歳と高齢であることより同種造血幹細胞移植の適応となる症例が限ら
れてきます。
同種造血幹細胞移植以外に根本的な治療法がないため、症状が軽く、重篤な合併症
がない場合には無治療で経過観察する場合が多い疾患です。
がない場合には無治療で経過観察する場合が多い疾患です。
薬物治療
1.蛋白同化ホルモン(ダナゾール)
子宮内膜症、乳腺症に用いられている蛋白同化ホルモンは再生不良性貧血、特発性
血小板減少性紫斑病に用いられておりますが、骨髄線維症に対する効果については
2005年に輸血依存性またはヘモグロビン10g/dl未満の30例(年齢中央値64歳)での臨
床検討が報告されました(Ref 6)。30例中8例(26.7%)ではヘモグロビン値が正常化、3
例ではヘモグロビン値が1.5g/dl以上の上昇が認められました。ダナゾール減量後も5例
(16.7%)では効果が持続しておりました(Ref 3)。また本邦においては39例(年齢中央
値67歳)に投与され、ヘモグロビン1.5g/dl以上の上昇が17例(43.6%)にみられ、輸血
依存性であった25例中8例(32.0%)では輸血非依存性となっております。
血小板減少性紫斑病に用いられておりますが、骨髄線維症に対する効果については
2005年に輸血依存性またはヘモグロビン10g/dl未満の30例(年齢中央値64歳)での臨
床検討が報告されました(Ref 6)。30例中8例(26.7%)ではヘモグロビン値が正常化、3
例ではヘモグロビン値が1.5g/dl以上の上昇が認められました。ダナゾール減量後も5例
(16.7%)では効果が持続しておりました(Ref 3)。また本邦においては39例(年齢中央
値67歳)に投与され、ヘモグロビン1.5g/dl以上の上昇が17例(43.6%)にみられ、輸血
依存性であった25例中8例(32.0%)では輸血非依存性となっております。
2.サリドマイド
骨髄線維症は高度の血管新生が認められることから血管新生を抑制するサリドマイド
の効果が期待され、欧米において臨床試験が行われました。当初の臨床試験では21例
に対して100mgから開始、最大400mgが投与されたところ、30日以上サリドマイドが投与
された13例中8例に貧血、血小板減少の改善が得られました。しかしながら21例中19例
(90.5%)に副作用がみられ、16例(76.2%)が副作用のため3ヶ月以内に試験中止とな
りました(Ref 7)。2003年に21例の骨髄線維症に対して少量サリドマイド(50mg)とプレド
ニン(0.5mg/kg)併用療法が試みられました。3ヶ月以内の脱落率は5%と低く、かつ輸
血非依存となった症例が40%、血小板5万/μl以上への上昇が76%に得られております
(Ref 8)。2004年に再びサリドマイド一日投与量を増加させた検討では副作用のため約
25%の症例が中止となっております(Ref 9,Ref 10)。
の効果が期待され、欧米において臨床試験が行われました。当初の臨床試験では21例
に対して100mgから開始、最大400mgが投与されたところ、30日以上サリドマイドが投与
された13例中8例に貧血、血小板減少の改善が得られました。しかしながら21例中19例
(90.5%)に副作用がみられ、16例(76.2%)が副作用のため3ヶ月以内に試験中止とな
りました(Ref 7)。2003年に21例の骨髄線維症に対して少量サリドマイド(50mg)とプレド
ニン(0.5mg/kg)併用療法が試みられました。3ヶ月以内の脱落率は5%と低く、かつ輸
血非依存となった症例が40%、血小板5万/μl以上への上昇が76%に得られております
(Ref 8)。2004年に再びサリドマイド一日投与量を増加させた検討では副作用のため約
25%の症例が中止となっております(Ref 9,Ref 10)。
同種造血幹細胞移植
造血幹細胞移植前には移植片を生着させるための治療が必要になります。これを移
植前処置と言いますが、極めて強力な治療であるため治療関連毒性によって死亡する
可能性があります。従って高齢者、臓器障害を有する症例ではこれまでは移植適応に
はなっておりませんでした。1990年代になり、これまでの移植前処置(骨髄破壊的前処
置)よりも抗癌剤の量を低減し、免疫抑制効果の高い抗癌剤あるいは免疫抑制剤を加
えることでも移植片の生着が可能であることが判明(骨髄非破壊的前処置)し、高齢者、
臓器障害を有する症例に対しても造血幹細胞移植が適応されるようになりました。
植前処置と言いますが、極めて強力な治療であるため治療関連毒性によって死亡する
可能性があります。従って高齢者、臓器障害を有する症例ではこれまでは移植適応に
はなっておりませんでした。1990年代になり、これまでの移植前処置(骨髄破壊的前処
置)よりも抗癌剤の量を低減し、免疫抑制効果の高い抗癌剤あるいは免疫抑制剤を加
えることでも移植片の生着が可能であることが判明(骨髄非破壊的前処置)し、高齢者、
臓器障害を有する症例に対しても造血幹細胞移植が適応されるようになりました。
1.骨髄破壊的造血幹細胞移植
骨髄線維症は線維化が著明であり、造血巣はほとんど認められません。同種造血幹
細胞移植施行後の生着不全は2-10%であり、半数以上の症例において骨髄線維化が
消失し、造血細胞が生着します。しかしながら骨髄線維症に対する骨髄破壊的造血幹
細胞移植の問題点は移植関連死亡が高いこと(100日で14-25%、1年で24-48%)であ
り、これによって総生存率は39-71%となっております(Ref 11,Ref 12,Ref 13,Ref 14,,
Ref 15)。
細胞移植施行後の生着不全は2-10%であり、半数以上の症例において骨髄線維化が
消失し、造血細胞が生着します。しかしながら骨髄線維症に対する骨髄破壊的造血幹
細胞移植の問題点は移植関連死亡が高いこと(100日で14-25%、1年で24-48%)であ
り、これによって総生存率は39-71%となっております(Ref 11,Ref 12,Ref 13,Ref 14,,
Ref 15)。
2.骨髄非破壊的造血幹細胞移植
骨髄破壊的造血幹細胞移植では移植関連死亡率が高いことより移植前処置治療を低
減した骨髄非破壊的造血幹細胞移植が試みられました。2つの報告(両者ともに症例数
は21例)では生着不全は0%、治療関連死亡は16%、10%、総生存率は84%、85%と
非常に良好な成績が得られており、今後、骨髄線維症に対する移植法として期待ができ
るものと考えられます(Ref 16,Ref 17)。
減した骨髄非破壊的造血幹細胞移植が試みられました。2つの報告(両者ともに症例数
は21例)では生着不全は0%、治療関連死亡は16%、10%、総生存率は84%、85%と
非常に良好な成績が得られており、今後、骨髄線維症に対する移植法として期待ができ
るものと考えられます(Ref 16,Ref 17)。
予後
本邦での検討(298症例)では5年生存率は68.6%、10年生存率は51.1%、平均生存
期間は10年と報告されています。死因は感染症33%、白血化19%、心不全12%、脳血
管障害11%の順となっています。予後不良因子としては(1)Hb 10g/dl未満の貧血、(2)
発熱・発汗・体重減少などの症状の持続、(3)末梢血に1%以上の芽球の出現、(4)男性
であることが挙げられました。これらの予後不良因子を1つ以下しか有さない症例の10
年生存率は84%、2つ以上有する症例では31%と報告されています。同種造血幹細胞
移植においては予後良好群と予後不良群の間で生存率に差は認めておらず、予後不良
群の予後を改善できる可能性が示唆されています。
期間は10年と報告されています。死因は感染症33%、白血化19%、心不全12%、脳血
管障害11%の順となっています。予後不良因子としては(1)Hb 10g/dl未満の貧血、(2)
発熱・発汗・体重減少などの症状の持続、(3)末梢血に1%以上の芽球の出現、(4)男性
であることが挙げられました。これらの予後不良因子を1つ以下しか有さない症例の10
年生存率は84%、2つ以上有する症例では31%と報告されています。同種造血幹細胞
移植においては予後良好群と予後不良群の間で生存率に差は認めておらず、予後不良
群の予後を改善できる可能性が示唆されています。
今後、移植関連死亡率が低い骨髄非破壊的造血幹細胞移植が積極的に施行される
ようになるものと考えられますが、平均生存期間が比較的長く、高齢者での発症が多い
ため、移植適応群の同定が非常に重要になります。
ようになるものと考えられますが、平均生存期間が比較的長く、高齢者での発症が多い
ため、移植適応群の同定が非常に重要になります。
2008年3月3日初稿
|
|

