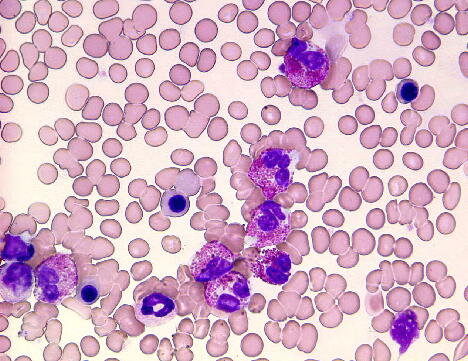
好酸球は健常人の場合には白血球の0.5-7%を占めております。形態学的には好中
球よりも若干大きく、細胞質に粗大な好酸性顆粒を有しています。好酸球の大部分は組
織中に存在(気道、肺、胃、腸管、子宮など)、末梢血中の好酸球は絶対数では350/μl
未満に調整されています。これ以上に好酸球が増加する場合を好酸球増加症と呼びま
す。好酸球増加症には原発性と基礎疾患に続発して生じる二次性好酸球増加症があり
ます(表1)。
球よりも若干大きく、細胞質に粗大な好酸性顆粒を有しています。好酸球の大部分は組
織中に存在(気道、肺、胃、腸管、子宮など)、末梢血中の好酸球は絶対数では350/μl
未満に調整されています。これ以上に好酸球が増加する場合を好酸球増加症と呼びま
す。好酸球増加症には原発性と基礎疾患に続発して生じる二次性好酸球増加症があり
ます(表1)。
1.アレルギー/過敏性疾患・感染症
喘息、鼻炎、薬剤性、アレルギー性気管支肺アスペルギルス症、アレルギー性腸炎、寄生虫症、細菌/抗酸菌症、真菌、ウイルス、リケッチア
2.膠原病
Churg-Strauss症候群、Wegener肉芽腫症、関節リウマチ、結節性動脈炎、全身性エリテマトーデス、皮膚硬化症、好酸性筋膜炎/筋炎
3.肺疾患
気管支拡張症、嚢胞性線維症、Loeffler症候群、肺好酸球性肉芽腫症
4.心疾患
熱帯性心内膜線維症、好酸球性心内膜線維症もしくは心内膜炎
5.皮膚疾患
アトピー性皮膚炎、蕁麻疹、湿疹、水疱性類天疱瘡、ヘルペス性皮膚炎
6.消化管疾患
好酸球性腸炎、腹腔内疾患
7.悪性腫瘍
ホジキンリンパ腫、非ホジキンリンパ腫、急性リンパ性白血病、ランゲルハンス細胞組織球症、木村氏病、血管免疫芽球性リンパ節腫脹、固形癌(腎臓、肺、乳腺、血管新生物、婦人科生殖器癌)
8.免疫系の疾患/異常
Wiskott-Aldrich症候群、高IgE症候群、高IgM症候群、IgA欠損症
9.代謝異常
副腎不全
|
特発性好酸球増加症(hypereosinophilic syndrome、HES)は1968年に疾患概念が提
唱され(Ref)、その診断基準は1975年に作成されました(Ref)(表2)。その内容は除外
診断であり、多くの病態が包括される不均一な症候群と考えられていました。
唱され(Ref)、その診断基準は1975年に作成されました(Ref)(表2)。その内容は除外
診断であり、多くの病態が包括される不均一な症候群と考えられていました。
1.1500/μl以上の好酸球増多が6ヶ月間以上持続、または好酸球増多で6ヶ月以内に死亡
2.寄生虫、アレルギーその他の好酸球増多をきたす明らかな基礎疾患がない
3.好酸球浸潤による臓器障害の症候(肝脾腫、器質性心雑音、うっ血性心不全、中枢神経症状、肺線維症、発熱、体重減少、貧血)の存在
|
2001年WHO分類ではHESは慢性好酸球性白血病(chronic eosinophilic leukemia、
CEL)と一括して骨髄増殖性疾患に含まれていました。それはCELの診断には好酸球の
クローナルな増殖を証明する必要がありましたが、通常の染色体検査で証明することが
困難でした。慢性骨髄性白血病の治療薬であるイマチニブがHESに有効と報告が見ら
れ(Ref)、2003年にCoolsら(Ref)はHESのおよそ半数にdel(4q12)に伴って、恒常的な
チロシンキナーゼ活性を有するFIP1L1-PDGFRα融合遺伝子を発見、これまでクロナリ
ティーの確認に至らなかった症例の一部はクローン性増殖であり、FIP1L1-PDGFRA融
合遺伝子陽性例では好酸球増加の原因が受容体型チロシンキナーゼPDGFRA
(platelet derived growth factor receptor A)の活性化によることが判明しました。
2008年に改訂されたWHO分類ではFIP1L1-PDGFRA融合遺伝子の検査がFISH法ある
いはRT-PCR法で必須となりました。骨髄検査で好酸球増多以外の異常がなく、かつク
ローナルなT細胞増殖も認めず、末梢血中の芽球が2%以上、もしくは骨髄における芽
球が5%以上、もしくは染色体異常があればCELと診断します。一方、骨髄検査で好酸
球増多以外の異常がなく、かつクローナルなT細胞増殖も認めず、末梢血の芽球が2%
以下、かつ骨髄における芽球が5%以下、かつ染色体異常がなければHESと診断しま
す。
CEL)と一括して骨髄増殖性疾患に含まれていました。それはCELの診断には好酸球の
クローナルな増殖を証明する必要がありましたが、通常の染色体検査で証明することが
困難でした。慢性骨髄性白血病の治療薬であるイマチニブがHESに有効と報告が見ら
れ(Ref)、2003年にCoolsら(Ref)はHESのおよそ半数にdel(4q12)に伴って、恒常的な
チロシンキナーゼ活性を有するFIP1L1-PDGFRα融合遺伝子を発見、これまでクロナリ
ティーの確認に至らなかった症例の一部はクローン性増殖であり、FIP1L1-PDGFRA融
合遺伝子陽性例では好酸球増加の原因が受容体型チロシンキナーゼPDGFRA
(platelet derived growth factor receptor A)の活性化によることが判明しました。
2008年に改訂されたWHO分類ではFIP1L1-PDGFRA融合遺伝子の検査がFISH法ある
いはRT-PCR法で必須となりました。骨髄検査で好酸球増多以外の異常がなく、かつク
ローナルなT細胞増殖も認めず、末梢血中の芽球が2%以上、もしくは骨髄における芽
球が5%以上、もしくは染色体異常があればCELと診断します。一方、骨髄検査で好酸
球増多以外の異常がなく、かつクローナルなT細胞増殖も認めず、末梢血の芽球が2%
以下、かつ骨髄における芽球が5%以下、かつ染色体異常がなければHESと診断しま
す。
骨髄増殖性腫瘍
1.慢性骨髄性白血病
2.真性多血症
3.本態性血小板血症
4.原発性骨髄線維症
5.慢性好中球性白血病
6.慢性好酸球性白血病
7.好酸球増加症候群
8.分類不能の慢性骨髄増殖性腫瘍
9.肥満細胞性疾患
好酸球やその他のPDGFA、PDGFRBやFGFR1異常を伴う骨髄球系腫瘍
1.PDGFA再構成を伴う骨髄球系腫瘍
2.PDGFB再構成を伴う骨髄球系腫瘍
3.FGFR1再構成を伴う骨髄球系腫瘍
|
HES/CELは好酸球増加による心筋への好酸球浸潤をもたらし、これによって心筋炎
(心筋細胞の広汎な脱落と線維化を伴う)を発症、これが死因の一つとして報告されてい
ます。心筋障害の原因としては好酸顆粒に含まれるmajor basic proteinや
eosinoohilic cationic proteinが放出され、血管内皮細胞の障害や凝固亢進を誘導して
血栓形成を誘導するためと報告されています。イマチニブによる治療前の治療としては
非可逆的な心筋障害を阻止するために副腎ステロイドによる好酸球数のコントロールが
一般的でした。副腎ステロイドに対してFIP1L1-PDGFRA融合遺伝子陰性HESの反応性
は良好ですが、FIP1L1-PDGFRA融合遺伝子陽性CELでは不良であり、イマチニブ投与
の適応となります(Ref)(Ref)。イマチニブの初期投与量および至適投与量については
100~400mg/日と様々であり、症例数が少ないこともあり決定されておりません。
FIP1L1-PDGFRα融合遺伝子陽性CELについてはほぼ100%の症例が血液学的寛解
に至ります。2007年、Baccaraniらは63例のHES/CELに対してイマチニブの投与を施行
(63例中27例がFIP1L1-PDGFRα融合遺伝子陽性)しました(Ref)。イマチニブは
100mg/日で開始、1週ごとに100mgの割で400mg/日まで増量し、同量を1年間継続する
投与法です(その後は適宜調節)。FIP1L1-PDGFRA融合遺伝子陽性例全例に血液学
的寛解が得られ(1ヶ月以内)、かつ全例でRT-PCR法によるFIP1L1-PDGFRA融合遺
伝子陽性クローンの消失(分子遺伝子学的寛解状態)が得られております(イマチニブ
投与後1~10ヶ月、中央値3ヶ月)。この内、3例がイマチニブ中断となり、2~6ヶ月後に
再度FIP1L1-PDGFRα融合遺伝子陽性クローンが検出、イマチニブ再開によって消失
が認められています。FIP1L1-PDGFRA融合遺伝子陰性例36例のHES/CELにおいても
血液学的寛解が14%(5例)に認められましたが、その効果は一過性であったと報告さ
れています。
(心筋細胞の広汎な脱落と線維化を伴う)を発症、これが死因の一つとして報告されてい
ます。心筋障害の原因としては好酸顆粒に含まれるmajor basic proteinや
eosinoohilic cationic proteinが放出され、血管内皮細胞の障害や凝固亢進を誘導して
血栓形成を誘導するためと報告されています。イマチニブによる治療前の治療としては
非可逆的な心筋障害を阻止するために副腎ステロイドによる好酸球数のコントロールが
一般的でした。副腎ステロイドに対してFIP1L1-PDGFRA融合遺伝子陰性HESの反応性
は良好ですが、FIP1L1-PDGFRA融合遺伝子陽性CELでは不良であり、イマチニブ投与
の適応となります(Ref)(Ref)。イマチニブの初期投与量および至適投与量については
100~400mg/日と様々であり、症例数が少ないこともあり決定されておりません。
FIP1L1-PDGFRα融合遺伝子陽性CELについてはほぼ100%の症例が血液学的寛解
に至ります。2007年、Baccaraniらは63例のHES/CELに対してイマチニブの投与を施行
(63例中27例がFIP1L1-PDGFRα融合遺伝子陽性)しました(Ref)。イマチニブは
100mg/日で開始、1週ごとに100mgの割で400mg/日まで増量し、同量を1年間継続する
投与法です(その後は適宜調節)。FIP1L1-PDGFRA融合遺伝子陽性例全例に血液学
的寛解が得られ(1ヶ月以内)、かつ全例でRT-PCR法によるFIP1L1-PDGFRA融合遺
伝子陽性クローンの消失(分子遺伝子学的寛解状態)が得られております(イマチニブ
投与後1~10ヶ月、中央値3ヶ月)。この内、3例がイマチニブ中断となり、2~6ヶ月後に
再度FIP1L1-PDGFRα融合遺伝子陽性クローンが検出、イマチニブ再開によって消失
が認められています。FIP1L1-PDGFRA融合遺伝子陰性例36例のHES/CELにおいても
血液学的寛解が14%(5例)に認められましたが、その効果は一過性であったと報告さ
れています。
主な死因として報告されている心筋障害に対してはイマチニブ投与により25%程度の
改善率が得られておりますが、心筋の線維化が進行した症例では改善率が低下しま
す。従って、好酸球の臓器浸潤が著しい症例においては早期よりイマチニブによる治療
が必要です(Ref)。しかしながら心筋障害合併例ではイマチニブ投与によって好酸球が
崩壊し、前述した好酸顆粒内物質が一気に放出されることによる心源性ショックが報告
されているため、ステロイドの予防内服が推奨されています(Ref)。
改善率が得られておりますが、心筋の線維化が進行した症例では改善率が低下しま
す。従って、好酸球の臓器浸潤が著しい症例においては早期よりイマチニブによる治療
が必要です(Ref)。しかしながら心筋障害合併例ではイマチニブ投与によって好酸球が
崩壊し、前述した好酸顆粒内物質が一気に放出されることによる心源性ショックが報告
されているため、ステロイドの予防内服が推奨されています(Ref)。
これまでの報告からはFIP1L1-PDGFRA融合遺伝子HES/CELに対しては以下のよう
にまとめることができます。
にまとめることができます。
①イマチニブ100~400mg/日投与により血液学的寛解および分子遺伝子学的寛解に至
る
る
②しかしながら中止することによりFIP1L1-PDGFRA融合遺伝子陽性クローン増加が見
られるため維持療法が必要である(Ref)。その維持量については週1回の少量イマチニ
ブ(100mg/日あるいは200mg/日)で十分という報告(Ref)もありますが、至適維持投与
量決定には至っておりません。
られるため維持療法が必要である(Ref)。その維持量については週1回の少量イマチニ
ブ(100mg/日あるいは200mg/日)で十分という報告(Ref)もありますが、至適維持投与
量決定には至っておりません。
③①、②からイマチニブ単独治療によるFIP1L1-PDGFRA融合遺伝子陽性クローンの
完全排除は困難
完全排除は困難
平成21年3月24日初稿
|
|

